- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:47.
- Última modificação 2025-06-01 07:37.
A principal diferença entre reações de primeira e segunda ordem é que a velocidade das reações de primeira ordem depende da primeira potência da concentração do reagente na equação de velocidade, enquanto a velocidade das reações de segunda ordem depende da segunda potência da concentração termo na equação de taxa.
A ordem de uma reação é a soma das potências para as quais as concentrações dos reagentes são elevadas na equação da lei de velocidade. Existem várias formas de reações de acordo com esta definição; reações de ordem zero (essas reações não dependem da concentração de reagentes), reações de primeira ordem e reações de segunda ordem.
O que são reações de primeira ordem?
Reações de primeira ordem são reações químicas cuja velocidade de reação depende da concentração molar de um dos reagentes envolvidos na reação. Portanto, de acordo com a definição acima para a ordem da reação, a soma das potências para as quais as concentrações dos reagentes são elevadas na equação da lei de velocidade sempre será 1. Pode haver um único reagente que participa dessas reações. Então a concentração desse reagente determina a velocidade da reação. Mas às vezes, há mais de um reagente que participa dessas reações, então um desses reagentes determinará a velocidade da reação.
Vamos considerar um exemplo para entender este conceito. Na reação de decomposição de N2O5, forma-se NO2 e O 2 gases como produtos. Como ele tem apenas um reagente, podemos escrever a reação e a equação de velocidade da seguinte forma.
2N2O5(g) → 4NO2(g) + O 2(g)
Taxa=k[N2O5(g)]m
Aqui k é a constante de velocidade para esta reação e m é a ordem da reação. Portanto, a partir de determinações experimentais, o valor de m é 1. Assim, esta é uma reação de primeira ordem.
O que são reações de segunda ordem?
As reações de segunda ordem são reações químicas cuja velocidade de reação depende da concentração molar de dois dos reagentes ou da segunda potência de um reagente envolvido na reação. Portanto, de acordo com a definição acima para ordem de reação, a soma das potências para as quais as concentrações dos reagentes são elevadas na equação da lei da velocidade será sempre 2. Se houver dois reagentes, a velocidade da reação dependerá da primeira potência da concentração de cada reagente.
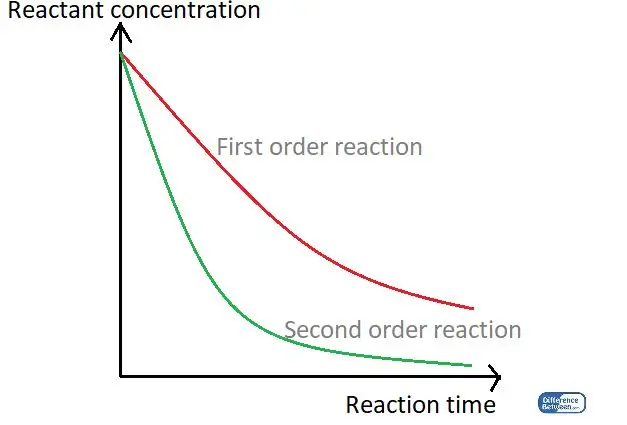
Figura 01: Um gráfico comparando os dois tipos de ordem de reação usando seu tempo de reação e a concentração do reagente.
Se aumentarmos a concentração de um reagente em 2 vezes (se houver dois reagentes na equação de velocidade), então a velocidade da reação aumenta em 4 vezes. Por exemplo, vamos considerar a seguinte reação.
2A → P
Aqui A é um reagente e P é o produto. Então, se esta é uma reação de segunda ordem, a equação de velocidade para esta reação é a seguinte.
Taxa=k[A]2
Mas para uma reação com dois reagentes diferentes, como segue;
A + B → P
Taxa=k[A]1[B]1
Qual é a diferença entre reações de primeira e segunda ordem?
Reações de primeira ordem são reações químicas cuja velocidade de reação depende da concentração molar de um dos reagentes envolvidos na reação. Portanto, se aumentarmos a concentração do reagente em 2 vezes, a velocidade da reação aumenta em 2 vezes. Reações de segunda ordem são reações químicas cuja velocidade de reação depende da concentração molar de dois dos reagentes ou da segunda potência de um reagente envolvido na reação. Portanto, se aumentarmos a concentração do reagente em 2 vezes, a velocidade da reação aumenta em 4 vezes. O infográfico abaixo apresenta a diferença entre reações de primeira e segunda ordem em forma de tabela.

Resumo - Reações de Primeira vs Segunda Ordem
Existem três tipos principais de reações de acordo com a ordem da reação; Reações de ordem zero, primeira e segunda ordem. A principal diferença entre reações de primeira e segunda ordem é que a velocidade de uma reação de primeira ordem depende da primeira potência da concentração do reagente na equação de velocidade, enquanto a velocidade de uma reação de segunda ordem depende da segunda potência do termo de concentração na equação de velocidade. equação de taxa.






